|



|
Bioanorganische Chemie
Unsere derzeitigen Forschungsprojekte beschäftigen sich im besonderen mit dem
biologischen Stickstoffmonoxid (NO) Metabolismus, d.h. der Synthese, Funktion, und dem Abbau
von Stickstoffmonoxid in der Biosphäre. Stickstoffmonoxid ist ein giftiges Gas, welches jedoch eine
überragende biologische Bedeutung besitzt. Daher wurde das NO im Jahr 1992 vom Magazin Science zum
Molekül des Jahres gewählt. Diese bahnbrechenden Ergebnisse stimulierten weitere Forschungsarbeiten,
und bis zu diesem Zeitpunkt ist bekannt, daß NO eine Schlüsselrolle für die Signalübertragung in Nervenzellen,
die Regulierung des Blutdrucks, die Blutgerinnung, und die Funktion von weißen Blutkörperchen spielt. Neue
biologische Funktionen von NO und der entsprechenden, ein-Elektronen reduzierten Spezies (dem 'Nitroxyl'-Ion),
werden immer noch entdeckt. Viele der biologischen Funktionen von Stickstoffmonoxid werden durch Häm-Proteine ausgeführt.
NO wird in vivo durch die Enzyme der Familie der Stickstoffmonoxid-Synthasen (NOS) dargestellt. Die Regulierung
des Blutdrucks kommt durch die Freisetzung kleiner Mengen NO (produziert durch endotheliale (e-) NOS) in den
Blutstrom und die Detektion des Stickstoffmonoxids durch die lösliche Guanylat-Zyklase (sGC) zustande. Dabei wird
sGC durch Bindung von NO an das Häm-Eisen(II) aktive Zentrum aktiviert. Interessanterweise wird die Rolle des
Stickstoffmonoxids fär die Erweiterung der Blutgefäße durch bestimmte blutsaugende Insekten ausgenutzt, die
NO in die Bißwunden ihrer Opfer injizieren. Dabei kommen zum Transport des Stickstoffmonoxids wiederum
Häm-Proteine, die sogenannten Nitrophorine (Np), zum Einsatz.
Unsere Forschung beschäftigt sich vornehmlich mit Modellsystemen fär die
Denitrifizierung, besonders fär
die Stickstoffmonoxid (NO)- und Dististickstoffoxid (N2O)-Reduktasen. Ein Schwerpunkt liegt dabei
auf der Erforschung
der verschiedenen Arten der Aktivierung von komplexgebundenem NO. Dazu werden Modellsysteme
mit Hilfe von Schlenk-Techniken synthetisiert und deren spektroskopische und elektrochemische Eigenschaften
erforscht. Diese werden dann mit Hilfe von quantenchemischen Rechnungen mit der experimentellen Reaktivität
dieser Systeme und den postulierten Mechanismen für die entsprechenden Enzyme korreliert. Die synthetischen
Arbeiten konzentrieren sich hauptsächlich auf Porphyrinliganden, entsprechende Übergangsmetallkomplexe und
deren Addukte mit NO.
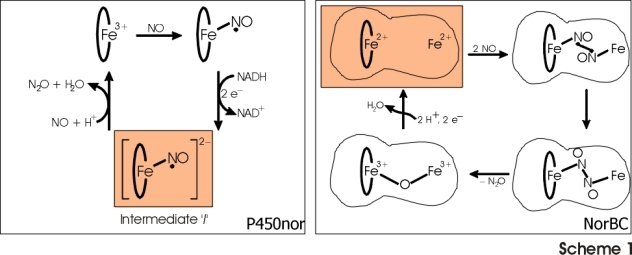
Ein besonderes Augenmerk liegt dabei auf den Stickstoffmonoxid-Reduktasen (NORs). Diese erlauben
einen Einblick in die Reaktivität von koordiniertem NO als Funktion der Struktur des aktiven
Zentrums der Enzyme. Bakterielle NOR (NorBC) reduziert NO zu N2O an einem aktiven
Zentrum, das aus einem Häm- und einem Nicht-Häm-Eisen in unmittelbarer Nachbarschaft besteht, wobei das Häm außerdem über einen
axialen Histidin-Liganden verfügt. Im Vergleich dazu wird die selbe Reaktion von der NO-Reduktase in Pilzen
(P450nor) katalysiert, jedoch an einem aktiven Zentrum, welches nur aus einem Häm mit axialer Thiolat-Koordination
besteht. Die beiden Enzyme NorBC und P450nor führen daher die gleiche Reaktion aus, jedoch unter Anwendung
eines völlig unterschiedlichen Reaktionsmechanismus wie in Schema 1 gezeigt. Die zentralen Ziele unserer Forschungarbeiten
sind die Aufklärung der Reaktionsmechanismen dieser Enzyme sowie die generellen Eigenschaften von Häm-Nitrosyl Addukten
als Funktion der trans-Liganden zu NO und Substitutionen an den Porphyrin-Liganden. Zur Erreichung dieser Ziele verfolgen
wir eine duale Strategie. Zum einen untersuchen wir 'einfache' Modellkomplexe vom Typ [Fe(TPP*)(L)(NO)]n+
(TPP* = Tetraphenylporphyrin-artiger Ligand; L = N-donor, Thiolat, etc.),
mit Hilfe derer Substitutionseffekte am Porphyrin und Effekte des trans-Liganden zu NO systematisch untersucht werden können.
Komplementär dazu beschäftigen wir uns mit der Synthese von komplizierteren Modellsystemen für die NO-Reduktasen. Die so
dargestellten Komplexverbindungen untersuchen wir dann mit einer Reihe von hochrangigen spektroskopischen Methoden
(siehe Research
home) in Korrelation mit Dichtefunktional- (DFT) Rechnungen. Die so erzielten Ergebnisse sind nicht nur von fundamentaler
Bedeutung für das Verständnis der Reaktionsmechanismen der NO-Reduktasen, sondern außerdem relevant für eine Reihe anderer
biologischer Funktionen von NO wie oben beschrieben.
In der dissimilatorischen Denitrifizierung entsteht Stickstoffmonoxid als Produkt der Reduktion von Nitrit.
Diese Reaktion wird unter anderem durch Cu Nitrit Reduktasen (CuNIR) katalysiert. In Kollaboration mit
Prof. Dr. Kiyoshi Fujisawa (University of Tsukuba, Japan) führen
wir Modellkomplexstudien an diesem Enzym durch unter Verwendung von
Hydrotris(pyrazolyl)borat-, Tris(pyrazolyl)methan- und Bis(pyrazolyl)methan-Liganden. Schließlich untersuchen wir die Koordinationschemie
von Distickstoffoxid, N2O, dem Produkt der Reduktion von NO, anhand von Ru(II)-Komplexen.
Research Highlights
 Electronic structure of Ferrous Heme-Nitrosyls
Electronic structure of Ferrous Heme-Nitrosyls
 Electronic structure of Ferric Heme-Nitrosyls
Electronic structure of Ferric Heme-Nitrosyls
 Effect of Axial Thiolate Coordination in Heme-Nitrosyls
Effect of Axial Thiolate Coordination in Heme-Nitrosyls
 Second Coordination Sphere Effects in Copper Complexes
Second Coordination Sphere Effects in Copper Complexes
 Non-heme Iron-Nitrosyl Complexes: Intermediates in bacterial NO Reductases
Non-heme Iron-Nitrosyl Complexes: Intermediates in bacterial NO Reductases

Prof. K. Fujisawa
|



